LES FLUIDES SUPERCRITIQUES
Fluides supercritiques : un fluide supercritique est une substance qui se trouve à une température et unepression supérieures à son point critique. Il peut se diffuser à travers les solides comme un gaz et dissoudre les matériaux comme un liquide. En outre, à proximité du point critique, de petites variations de pression ou de température entraînent de grandes variations de densité, ce qui permet d'ajuster avec précision de nombreuses propriétés d'un fluide supercritique. Les fluides supercritiques peuvent remplacer les solvants organiques dans un grand nombre de processus industriels et de laboratoire.
Le CO2 est un des fluides supercritiques plus utilisés dans le monde.
Le CO2 est un des fluides supercritiques plus utilisés dans le monde.
À QUOI SERVENT LES FLUIDES SUPERCRITIQUES
Graphiques des fluides supercritiques
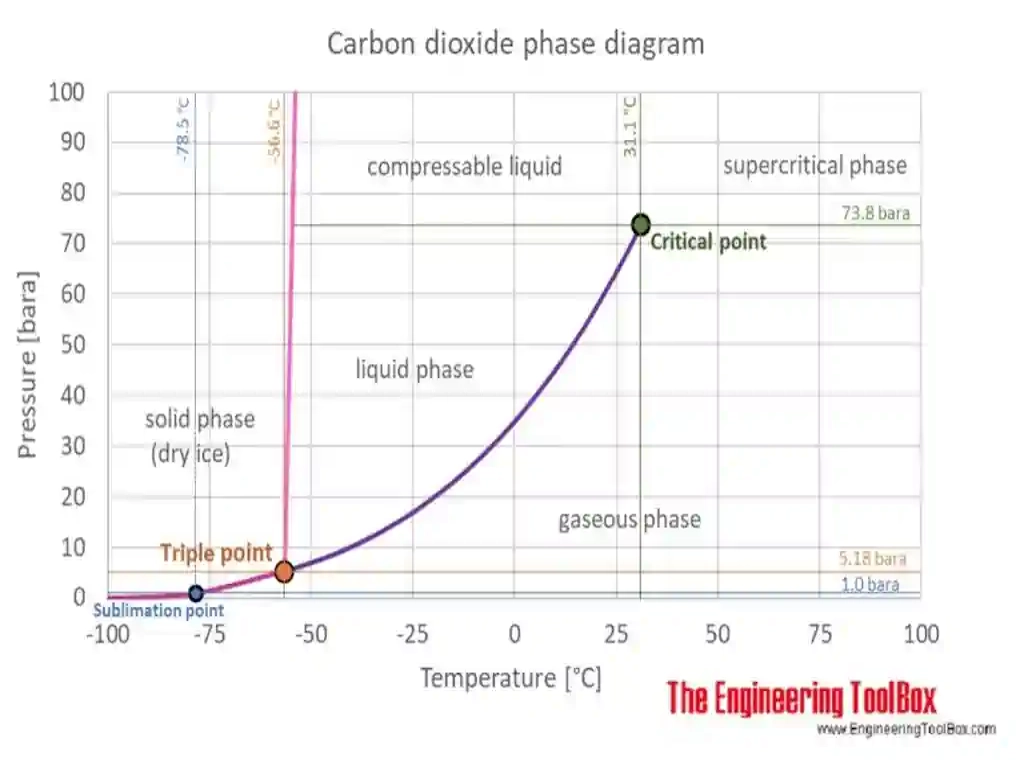
Diagramme de phase de CO2
Représentation de point triple et supercritique
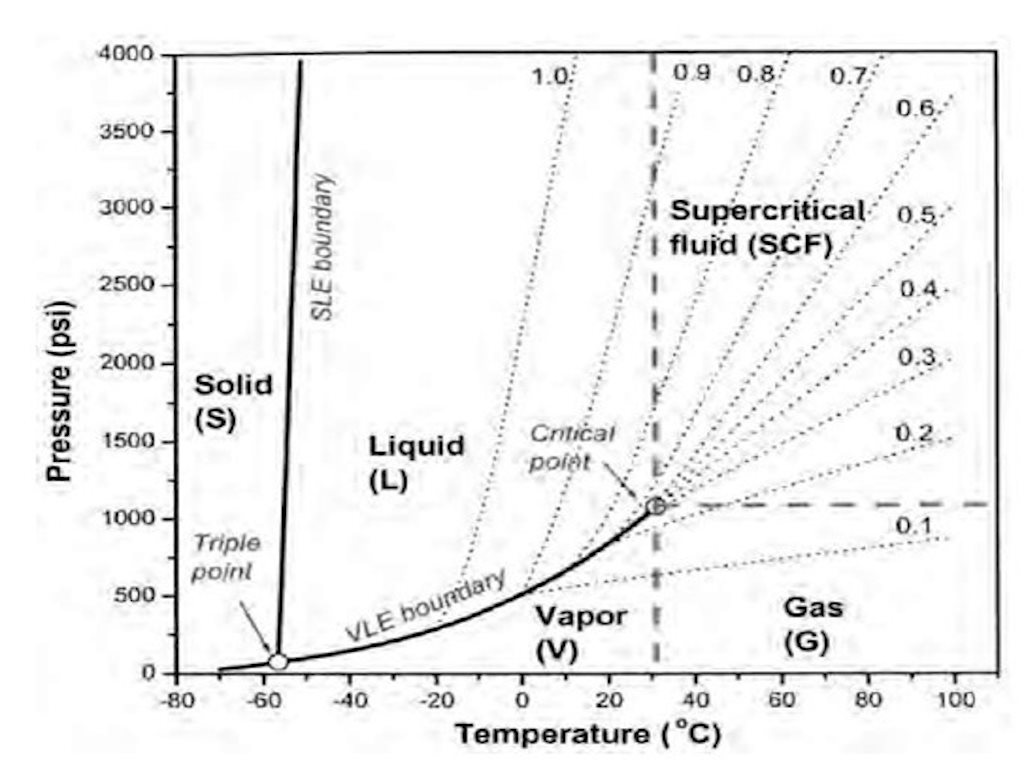
diagramme de densité
Représentation de la densité en fonction de la pression et de la température.

DIAGRAMME DE MOLLIER
Représentation des paramètres thermodynamiques.
AVANTAGES DES FLUIDES SUPERCRITIQUES:
LE CO2
Le CO2, le plus courant des fluides supercritiques, est très intéressant pour de nombreuses raisons:
• il est très bon marché et abondant sous forme pure (pour l'alimentation) dans le monde entier;
• il est ininflammable et non toxique;
• respectueux de l'environnement car le gaz n'est pas polluant et parce que la majeure partie du CO2 est produite en petites quantités;
• température critique de 31°C, permettant des opérations à une température proche de la température ambiante,
• d'éviter les altérations du produit;
• pression critique de 74 bars, conduisant à une pression de fonctionnement "acceptable", généralement comprise entre 100 et 350 bars.
• il est très bon marché et abondant sous forme pure (pour l'alimentation) dans le monde entier;
• il est ininflammable et non toxique;
• respectueux de l'environnement car le gaz n'est pas polluant et parce que la majeure partie du CO2 est produite en petites quantités;
• température critique de 31°C, permettant des opérations à une température proche de la température ambiante,
• d'éviter les altérations du produit;
• pression critique de 74 bars, conduisant à une pression de fonctionnement "acceptable", généralement comprise entre 100 et 350 bars.
Cosolvant : solvant organique ajouté aux principaux fluides supercritiques (généralement du dioxyde de carbone) pour modifier son pouvoir solvant sur les molécules « polaires » puisque le fluide ne peut dissoudre que les molécules « non polaires » ; en général le cosolvant est choisi parmi les alcools, les esters ou les cétones à chaîne courte. Pour des raisons évidentes, dans de nombreux cas, l'éthanol est préféré car il est abondant et économique sous sa forme pure (usage alimentaire, pharmacopée), peu dangereux pour l'environnement et peu toxique en quantité minime. En fait, il est utilisé en pourcentages minimes, entre 2% et 5%.
Le CO2 est disponible aussi bien en bouteilles ou packs de bouteilles du commerce de volume limité qu'en vrac à partir de réservoirs contenant de 4 à 30 tonnes de gaz liquéfié à une pression de 18 bars et une température d'environ -18° C. Ces réservoirs sont alimentés directement par des camions cryogéniques. Le prix est très sensible à la quantité livrée puisque le transport constitue le principal coût, car le dioxyde de carbone est disponible à un prix très bas.
Étant donné que la plupart des usines SCF nécessitent du dioxyde de carbone liquide à une pression d'environ 45 bars, le gaz liquéfié doit être comprimé de la pression de stockage (18 bars) à 50 bars via une pompe de surpression. Pour les applications dans les industries alimentaires et pharmaceutiques, il est obligatoire d'utiliser une pompe à double membrane pour éviter toute contamination par le lubrifiant de la pompe.




